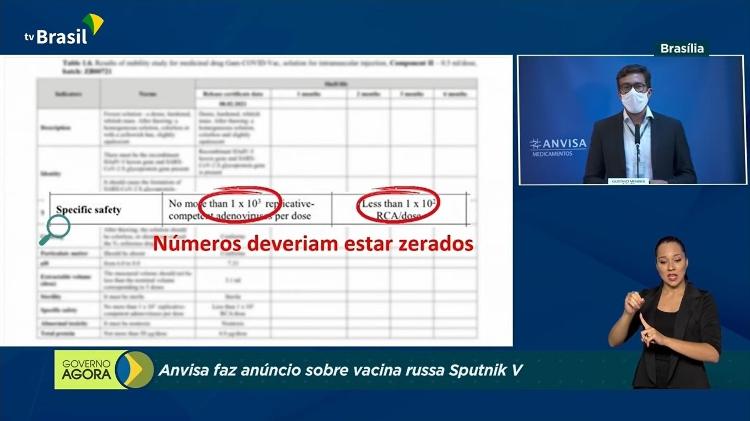
Anvisa reafirmou que a presença de adenovírus replicante na vacina representa riscos à segurança do imunizante russo.
A Anvisa (Agência Nacional de Vigilância Sanitária) manteve o tom de confronto hoje com os desenvolvedores da vacina contra a covid-19 Sputnik V após negar a importação e o uso emergencial do imunizante russo no Brasil. O diretor-presidente da agência, Antônio Barra Torres, disse que as alegações dos russos de que a Anvisa mentiu são um “ataque feito a um país e a um Estado”.
Em resposta às críticas do Instituto Gamaleya e do Fundo de Investimento Direto da Rússia, responsáveis pela produção da Sputnik V, a Anvisa fez uma transmissão ao vivo nas redes públicas de TV e rádio do governo federal. A agência federal mostrou documentos da vacina e apoiou seus argumentos em diálogos com representantes do imunizante, expostos em trechos de vídeo mostrados na transmissão.
Barra Torres afirmou que o órgão não “mentiu” nem atuou de maneira “antiética” para negar a autorização para a importação e uso da vacina. Após a transmissão ao vivo, o diretor da Anvisa ainda deu uma entrevista coletiva em que criticou os ataques à agência e disse esperar uma resposta com “argumento científico” dos russos.
“Esperamos que esse problema seja solucionado com ciência, com argumento científico”, disse Barra Torres, reforçando que os problemas apontados pela Anvisa estão diretamente ligados à segurança do imunizante. “Ninguém vai ser vacinado com documento, as pessoas vão ser vacinadas com vacinas”, afirmou sobre a possibilidade de correção da documentação.
Já o gerente-geral de Medicamentos e Produtos Biológicos da Anvisa, Gustavo Mendes, reforçou que a documentação da vacina não provou ser segura quanto à presença do adenovírus replicante. “Uma vacina tem de proteger. Uma vacina não pode causar dano”, disse.
Mendes também afirmou que a fabricante da Sputnik V justificou a não replicação de apenas um dos componentes do tipo no imunizante, apesar de a vacina conter dois.
Para comprovar a tese, a agência apresentou diálogos com os desenvolvedores russos em que fez os apontamentos que justificaram o veto à importação. No entanto, a Anvisa afirma que não recebeu explicações suficientes que justificassem o aval para o imunizante.
Apesar do tom crítico em relação aos russos, Barra Torres tentou mediar o conflito e afirmou que o órgão “está sempre receptivo para avaliar novos estudos e informações que podem ser enviadas pelo desenvolvedor de vacina no processo de autorização de uso emergencial ou no pedido de importação”.
Diálogos
Nos trechos selecionados pela Anvisa da reunião virtual com representantes do Instituto Gamaleya, funcionários da agência brasileira expõem seus questionamentos sobre a presença do adenovírus replicante na produção do imunizante. A agência não identificou quem eram em específico os interlocutores. Confira o diálogo:
Representante da Anvisa 1
– Eu acho que fiz isso antes, mas, de qualquer forma, precisamos entender por que, uma vez que vocês detectaram a presença de adenovírus replicante na produção, por que vocês não voltaram ao desenvolvimento e escolheram um outro substrato celular que tivesse plasmídeos celulares construídos de uma forma que tivesse muitos poucos sites homólogos, que geralmente não permitem uma recombinação do adenovírus com as células.
Representante da Anvisa 2
– Eu ia dizer, quando vocês continuaram com esse desenvolvimento, qual foi a avaliação de risco conduzida para realmente avaliar o risco da presença dessas partículas na vacina? Porque será administrada em pessoas saudáveis. Então, qual a justificativa que vocês têm para seguir com esse desenvolvimento de uma vacina que será usada em pessoas saudáveis? Isso é algo que deveria ser considerado na avaliação de risco e nós querermos ter detalhes sobre isso.
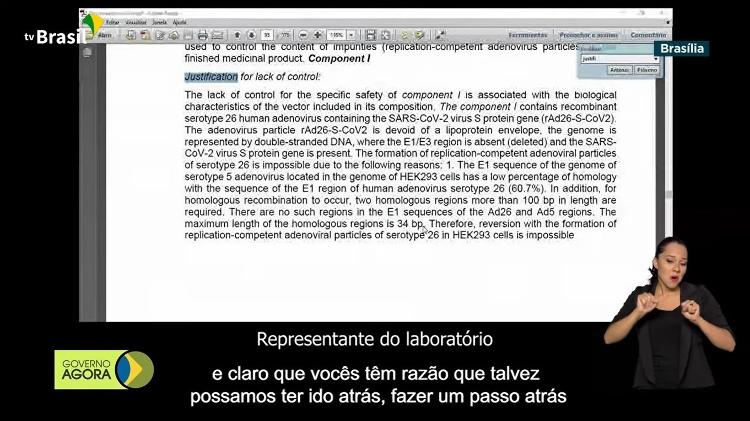
Representante do laboratório russo interpretado por tradutora contratada pelo Instituto Gamaleya
– Então talvez eu vou traduzir um pouquinho aquilo que acabam de dizer os representantes da Gamaleya. Eles disseram que para a produção da vacina usaram uma linha de células caracterizada, o que pode ter seus defeitos e claro que vocês têm razão que talvez possamos ter ido atrás, fazer um passo atrás, e começar usando uma nova substância, mas dizem que esse processo devia ter ocupado muito tempo, assim nós optamos por outra, por a mesma substância que usamos no início.
A Anvisa afirma que as pausas dos russos chegaram a quatro minutos enquanto discutiam os questionamentos feitos pela agência brasileira, mas que a tradutora contratada por eles não traduziu esses momentos. Por fim, a Anvisa mostrou um trecho em que os russos dão a entender que têm consciência da solicitação feita pela agência brasileira.
Representante do laboratório russo
– Nós recebemos a questão e talvez depois dessa reunião nós podemos receber novas questões depois da reunião, seria de muita ajuda para nós.
Decisão polêmica
A decisão que impediu a importação do imunizante foi tomada na última segunda-feira (26/04), quando a diretoria da entidade proferiu um voto unânime contra a vacina. Para basear sua posição, o relator do caso, o diretor Alex Machado Campos, pediu que três técnicos explanassem sobre os possíveis problemas que teriam encontrado nos documentos russos.
Ao falar, Gustavo Mendes, informou que a Sputnik V poderia ser “prejudicial à saúde humana”. Isso porque, segundo a Anvisa, a vacina usa um tipo de vírus que naturalmente se replica.
“Isso significa que o vírus que deve ser utilizado apenas para carregar material genético do coronavírus para as células humanas e, assim, promover a resposta imune, ele mesmo se replica, e isso é uma não conformidade grave”, disse à época.
O colegiado da agência tinha se reunido de forma extraordinária para cumprir decisão do ministro do STF (Supremo Tribunal Federal) Ricardo Lewandowski, que havia concedido um prazo de 30 dias para que o órgão regulador decidisse sobre o uso do imunizante.
Na quarta-feira (28/04), o Consórcio Nordeste solicitou à agência “o acesso integral” dos documentos que embasaram a decisão da Anvisa. Os governadores avaliam acionar o STF (Supremo Tribunal Federal) para a aprovação do imunizante russo.
O pedido de uso emergencial da Sputnik V foi protocolado pela União Química, responsável pela vacina no Brasil, no dia 25 de março.